奇克欧
盐酸格拉司琼注射液
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:盐酸格拉司琼注射液
英文名称:Granisetron Hydrochloride Injection
汉语拼音:Yansuan Gelasiqiong Zhusheye
【成份】
本品主要成份为盐酸格拉司琼,辅料为:氯化钠,注射用水。
化学名称:1-甲基-N-[9-甲基-桥-9-氮杂双环[3,3,1]壬烷-3-基]-1H-吲唑-3-甲酰胺盐酸盐。
化学结构式:
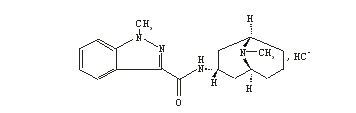
分子式:C18H24N4O·HCl
分子量:348.88
【性状】
本品为无色的澄明液体。
【适应症】
用于放射治疗、细胞毒类药物化疗引起的恶心和呕吐。
【规格】
3ml:3mg(以C18H24N4O计)
【用法用量】
成人用量通常为3mg,用20~50ml 5%葡萄糖注射液或0.9%氯化钠注射液稀释后,于治疗前30分钟静脉注射,给药时间应超过5分钟。大多数病人只需给药一次,对恶心和呕吐的预防作用便可超过24小时,必要时可增加给药次数1~2次,但每日最高剂量不应超过9mg。老年人和肝、肾功能不全者无需调整剂量。
【不良反应】
常见的不良反应为头痛、倦怠、发热、便秘、偶有短暂性无症状肝转氨酶升高。上述反应轻微,无须特殊处理。
【禁忌】
1.对本品或有关化合物过敏者禁用。
2.胃肠道梗阻者禁用。
【注意事项】
1、由于本品可减慢消化道运动,故消化道运动障碍患者使用本品时应严密观察。
2、本品不应与其他药物混合使用。
3、本品应在配制24小时内使用。
【孕妇及哺乳期妇女用药】
1.孕妇除非必需外,不宜使用。
2.哺乳期妇女需慎用,若使用本品时应停止哺乳。
【儿童用药】
2~16岁的儿童推荐剂量为10μg/kg,2岁以下儿童用药情况尚不明确。
【老年用药】
老年人无需调整剂量。
【药物相互作用】
1、格拉司琼不会诱导或抑制细胞色素P-450药物代谢酶系统。
2、因为格拉司琼是通过肝细胞色素P-450药物代谢酶进行代谢,诱导或抑制此酶可以改变清除率和格拉司琼的半衰期。
【药物过量】
缺乏药物过量的报道。
【药理毒理】
药理作用
本品是一种高选择性的5-HT3受体拮抗剂,对因放疗、化疗及手术引起的恶心和呕吐具有良好的预防和治疗作用。放疗、化疗及外科手术等因素可引起肠嗜铬细胞释放5-HT,5-HT可激活中枢或迷走神经的5-HT3受体而引起呕吐反射。本品控制恶心和呕吐的机制,是通过拮抗中枢化学感受区及外周迷走神经末梢的5-HT3受体,从而抑制恶心、呕吐的发生。本品选择性高,无锥体外系反应和过度镇静等副作用。
毒理研究
遗传毒性:本品Ames试验、小鼠淋巴瘤细胞正向突变试验、小鼠微核试验及体内、体外大鼠肝细胞异常UDS试验结果均未出现致突变作用。但在HeLa细胞体外试验中出现UDS明显增加,体外人淋巴细胞染色体畸变试验中,多倍体细胞的数量明显增加。
生殖毒性:本品皮下给药剂量达6mg/kg/天(以体表面积算,为临床静脉给药推荐剂量的97倍)时,未现出对雌、雄大鼠生育力和生殖行为的影响。妊娠大鼠和家兔静脉给予本品剂量分别为9mg/kg/天(54mg/m2/天,按体表面积算,相当于临床静脉给药推荐剂量的146倍)及3mg/kg/天(35.4mg/m2/天,按体表面积算,相当于临床静脉给药推荐剂量的96倍)时,均未表现出对动物生育力和胎仔发育的影响,但尚无充分和严格对照的妊娠妇女给药的临床研究。由于动物试验并不总能预测药品对人体的影响,故只有在确实必需时,孕妇才可在妊娠期间使用本品。
目前尚不清楚本品是否通过乳汁分泌。因为许多药物可以经乳汁分泌,故哺乳妇女使用本品时应慎重考虑其对后代的影响。
致癌性:在两年的致癌试验中,大鼠经口给予本品的剂量分别为1、5、50mg/kg/天(6、30、300mg/m2/天),其中高剂量组在59周时因毒性反应而将剂量降低至25mg/kg/天。结果显示,5mg/kg/天以上组(包括该剂量组)雄性大鼠和25mg/kg/天组雌性大鼠(以体表面积算,其剂量分别为临床静脉给药推荐剂量的81倍以上和405倍)肝细胞癌和腺瘤发生率显著增加,而1mg/kg/天组雄性大鼠和5mg/kg/天组雌性大鼠(以体表面积算,分别为临床静脉给药推荐剂量的16倍和81倍)的肝肿瘤发生率未见增加。在12个月的试验中,经口给予本品100mg/kg /天(600mg/m2/天,以体表面积算,相当于临床静脉给药推荐剂
量的1622倍)的雄、雌大鼠均发生肝细胞腺瘤。而空白对照组未出现。本品给药24个月的小鼠致癌性试验结果显示,肿瘤的发生率未见有统计学意义的明显增加,但该试验尚未得出最后结论,因为在大鼠致癌性研究中出现肿瘤,故本品只应在说明书中推荐的剂量下和适应症范围内应用。
【药代动力学】
健康志愿者静脉注射本品20或40μg/kg后,平均血浆浓度峰值分别为13.7和42.8μg/L,血浆消除半衰期约3.1~5.9小时。本品体内分布广泛,血清蛋白结合率约为65%,大部分迅速代谢,主要代谢途径为N-去烷基化及芳香环氧化后再被共轭化,通过粪便和尿液排泄。
【贮藏】遮光,密闭保存。
【包装】低硼硅玻璃、中性硼硅玻璃安瓿包装,5支/盒、10支/盒。
【有效期】24个月
【执行标准】《中国药典》2010年版二部及国家食品药品监督管理局标准YBH01042005(性状)。
【批准文号】 国药准字H20053094
【生产企业】
企业名称:北大医药股份有限公司
网 址:www.fsspc.com
生产地址:重庆市江北区寸滩水口
邮政编码:400025
电话号码:8008070918
传真号码:023-67090228


